
Existem diferentes tipos de ligações químicas. Entre eles, covalente, metálico, van der Waals, hidrogênio e iônicos. Vamos descobrir o que é a ligação iônica e suas propriedades.
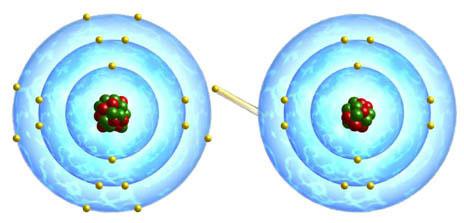
O átomo de metal desprende facilmente o elétron etorna-se um catião. Um átomo eletronegativo, como um átomo de halogéneo, leva facilmente um elétron, formando um íon carregado negativamente. Essas partículas carregadas - aniões e catiões - formam aquela que se chama "ligação iónica". Exemplos disso são cloreto de sódio, brometo de potássio, iodeto de lítio e outros halogenetos metálicos (principalmente alcalinos).

Não tem propriedades de diretividade e saturaçãoligação iónica. Exemplos de links com diretividade e saturação são covalentes, títulos doadores-aceitadores. O íon não saturado e não direcional se manifesta porque, quando os íons estão ligados a outra carga, não há compensação de carga completa. Outros íons carregados de forma oposta podem ser anexados, e assim por diante. É por isso que o número máximo de semelhantes ao redor do íon está localizado, mas com um sinal diferente. No entanto, este número é limitado devido à repulsão mútua de íons de igual carga. O equilíbrio é alcançado em seu determinado arranjo mútuo, que é caracterizado por um número de coordenação. Este índice depende da razão dos raios dos íons. Substâncias com uma ligação iónica muitas vezes têm uma coordenação de um cubo ou um octaedro e são cristais.
Assim, o cristal de sal de mesa - cloreto de sódio - tem uma rede cúbica. Nela, cada íon de cloreto é ligado a seis íons de sódio e cada íon de sódio - com seis íons de cloreto.

Em óxidos de metais alcalinos e alcalino-terrososuma ligação iónica também é observada. Exemplos de tais compostos são óxido de cálcio, óxido de sódio e outros. Os íons podem consistir não só de um átomo, mas também de vários. Dentro de um íon tão complexo é outro, e entre os próprios íons é um vínculo iónico. Exemplos: sais de tipo sulfato de potássio (aqui o potássio é um catião, um ião sulfato é um anião).
Deve também notar-se que as propriedades dos íonsAs substâncias diferem fortemente com as propriedades dos átomos e moléculas destas substâncias. Por exemplo, os íons de cloro que fazem parte do cloreto de sódio são incoloros e inodores e são adequados para alimentos, enquanto o cloro molecular, um gás amarelo esverdeado com um cheiro pungente, é um veneno. E os átomos de sódio com água reagem com a explosão, enquanto os íons se dissolvem livremente.
</ p>